- Fixer plus rapidement les caractères
- La culture d’embryons immatures
- Faciliter l’introduction de nouveaux caractères
- Le sauvetage d’embryons interspécifiques
- L'hybridation somatique
- La mutagénèse
- La transgénèse : domaines d'application
- La transgénèse : stratégies
- La transgénèse : les étapes
- L'obtention d’une variété OGM
- Les méthodes récentes
- CRISPR-CAS9
- La biologie de synthèse
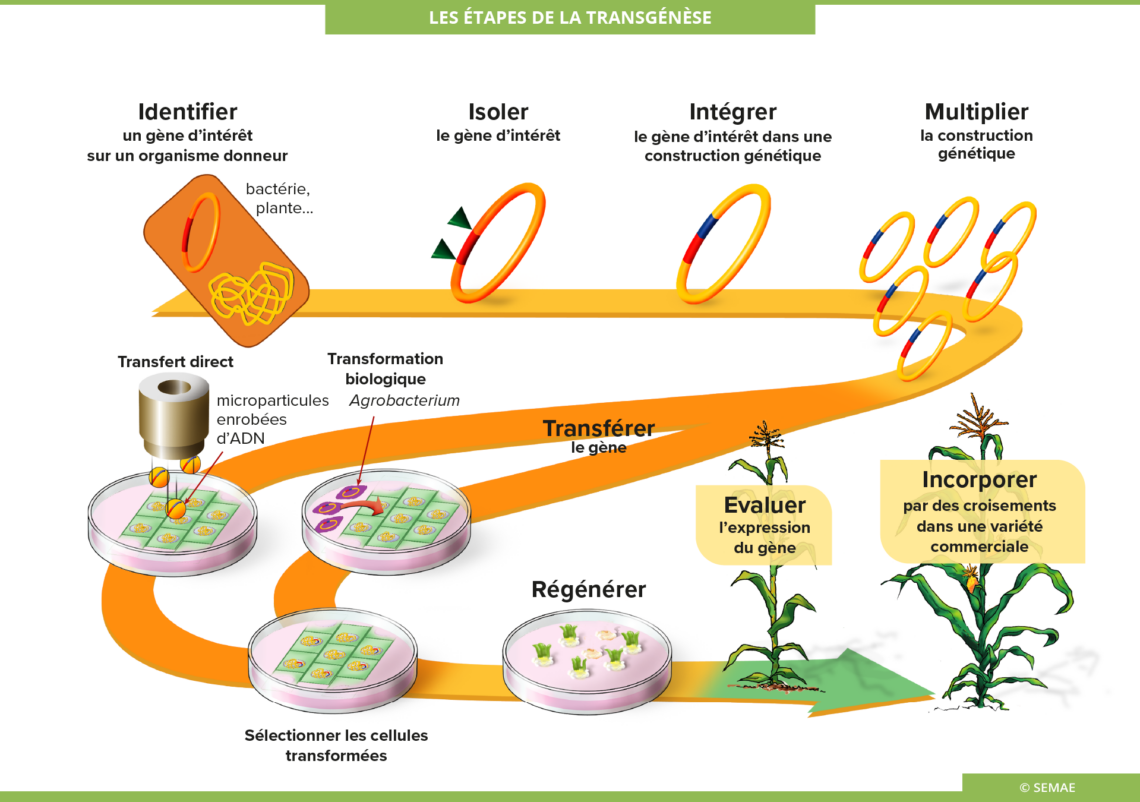
Les étapes de la transgénèse
Etape 1 : Identifier, isoler, intégrer et multiplier un gène d’intérêt
La première étape est le choix d’un caractère que l’on veut introduire dans la plante, comme par exemple des caractères de qualité nutritionnelle, la résistance à certains insectes, à certaines maladies, à des herbicides, etc. Ensuite, il faut procéder à l’identification et au clonage du ou des gènes à l’origine du caractère recherché. Ce gène d’intérêt peut provenir de tout organisme vivant, plante, animal ou bactérie puisque le code génétique est universel. Puis, il est intégré dans une construction génique associant souvent un gène marqueur. Ce gène marqueur permet de sélectionner les cellules qui ont intégré le gène d’intérêt. La construction est ensuite multipliée (clonée) afin de disposer d’une quantité suffisante d’ADN pour son introduction dans les cellules végétales que l’on veut transformer.
Etape 2 : Transférer le gène
Il y a plusieurs méthodes pour introduire un gène dans une cellule :
La transformation biologique. Cette technique utilise une bactérie du sol, Agrobacterium, qui a la propriété de réaliser naturellement la transformation génétique d’une plante, afin de la parasiter. Ainsi, une construction génique introduite dans la bactérie (rendue avirulente au préalable) sera transférée dans la plante et intégrée à son génome. Cette technique est la plus couramment utilisée.
Le transfert direct. Cette technique fait intervenir :
- soit une projection d’ADN (biolistique) dans les cellules de la plante par l’utilisation d’un canon à particules qui projette dans les cellules des microparticules de métal (or ou tungstène) enrobées des constructions géniques,
- soit l’introduction d’ADN dans des protoplastes, par action d’un agent chimique ou d’un champ électrique (électroporation).
Les cellules issues de différents types de tissus végétaux peuvent être soumises à la transformation. Selon les espèces, ce seront des disques foliaires, des sections de tige, des cotylédons, des embryons, des microspores ou des protoplastes. On utilise le plus fréquemment des disques foliaires comme pour le tabac ou la tomate.
Etape 3 : Régénérer et évaluer les plantes transformées
Après sélection des cellules transformées, il faut régénérer les nouvelles plantes transgéniques. Les cellules transformées se développent d’abord en cals, larges amas de cellules indifférenciées. Après quelques semaines, on observe le développement de pousses. Elles sont alors placées dans un nouveau milieu de culture permettant le développement des racines. Quand les racines sont suffisamment développées, les plantules sont repiquées en pot et acclimatées en serre.
La régénération in vitro des cellules transformées est une étape difficile à maîtriser. Aussi, le génotype, le type de tissus et les conditions de culture sont choisis en fonction de leur aptitude à la régénération.
Les plantes régénérées sont ensuite analysées à différents niveaux :
- Moléculaire : nombre de copies de transgène et intensité de son expression
- Biochimique : présence de l’enzyme traduite et de son activité
- Physiologique : morphologie de la plante, paramètres de croissance, photosynthèse, reproduction
- Agronomique : comportement en champ et paramètres agronomiques
- Ecologique : effet éventuel sur l’environnement
Etape 4 : Incorporer dans une variété commerciale
Les plantes transformées obtenues sont soumises à des croisements contrôlés pour étudier les modalités de transmission du nouveau caractère à la descendance.
La transformation et la régénération étant des opérations délicates, le génotype de la plante choisie est celui facilitant ces étapes. C’est pourquoi les plantes retenues sont ensuite soumises à une succession de rétrocroisements afin d’introduire le gène dans le matériel élite et d’obtenir de nouvelles variétés commerciales exprimant ce caractère.
LA TRANSFORMATION BIOLOGIQUE
Cette technique utilise une bactérie du sol, Agrobacterium, qui a la propriété de réaliser naturellement la transformation génétique d’une plante, afin de la parasiter.
Ainsi, une construction génique introduite dans la bactérie (rendue avirulente au préalable) sera transférée dans la plante et intégrée à son génome. Cette technique est la plus couramment utilisée.
Co-culture et transformation génique
La transformation génique est réalisée en mélangeant une culture d’une souche d’Agrobacterium transformée, mise en suspension en milieu liquide, avec des explants de la plante, on parle de co-culture. C’est au cours de cette étape que la construction génique introduite dans la bactérie est transférée dans le génome de la plante.
Sélection des cellules transformées
Après la co-culture, les explants sont lavés pour éliminer les agrobactéries. Il faut ensuite sélectionner les cellules qui sont effectivement transformées. Pour cela, on apporte dans la culture des explants un agent sélectif approprié : herbicide, antibiotique… Seules les cellules végétales transformées, possédant et exprimant le gène de sélection : résistance à un herbicide ou à un antibiotique, pourront se développer sur ce milieu.
Applications
Cette technique de transformation par Agrobacterium a été appliquée avec succès à différentes espèces végétales dont le colza, la tomate, le coton, la pomme de terre, le soja, la courgette, le tabac, le maïs, le riz…

L’aptitude à la transformation
Pour effectuer des transformations biologiques en routine, il est nécessaire d’avoir une méthode de transformation très efficace. Trois facteurs interviennent à ce niveau : la virulence de la souche bactérienne, la sensibilité des cellules vis à vis de la bactérie, et le choix du marqueur de sélection. La durée de la co-culture doit également être déterminée, un délai trop long peut affecter la survie des tissus et l’aptitude à la régénération.
Le prétraitement de l’explant
L’objectif du prétraitement est de provoquer des blessures à la surface de l’explant par projection de microparticules nues. Ceci favorise et localise la transformation par Agrobacterium au niveau de ces fines blessures. Cette technique est notamment utilisée pour la transformation de méristèmes.
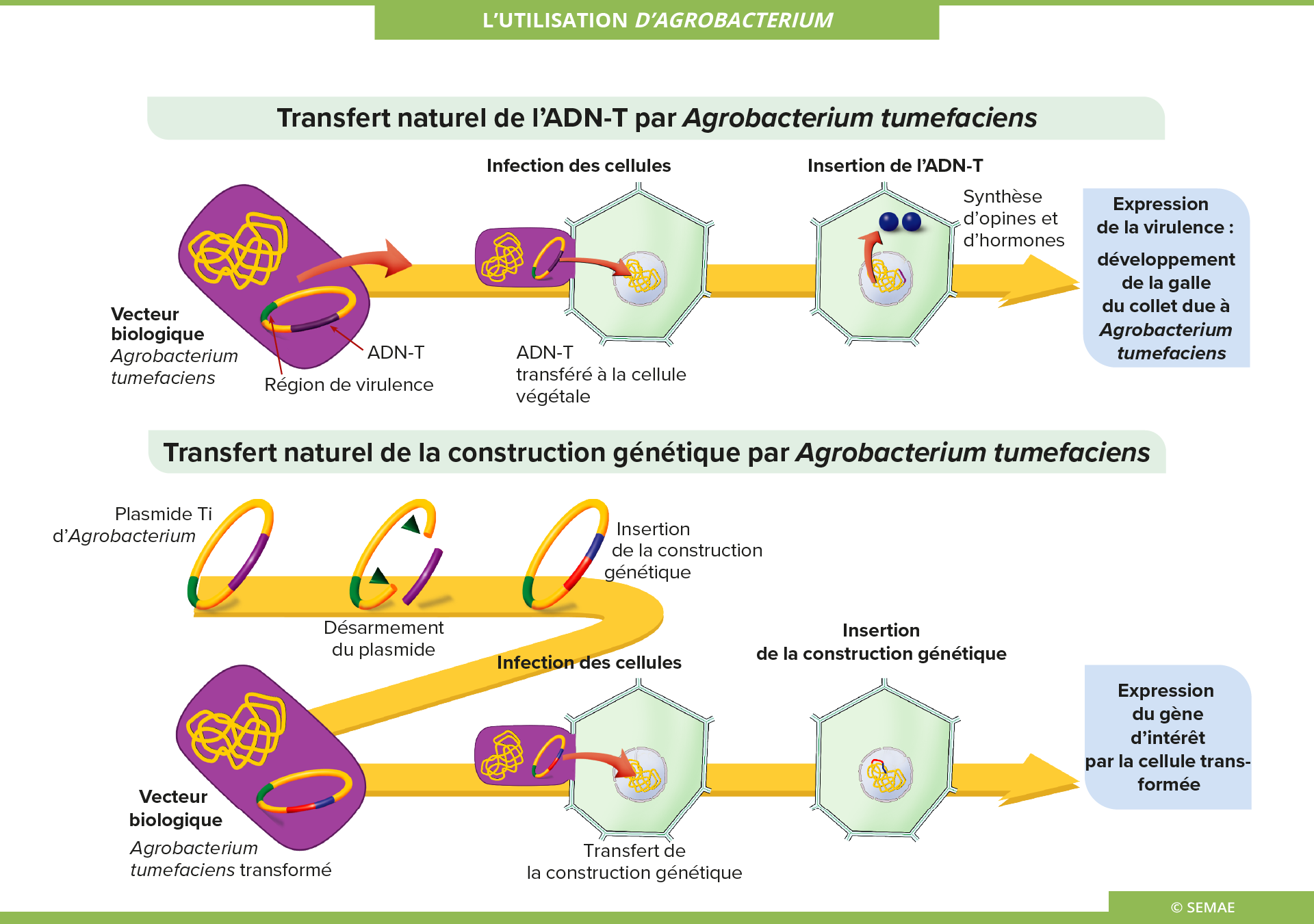
L'UTILISATION D'AGROBACTERIUM
La bactérie du sol Agrobacterium tumefaciens provoque chez les plantes infectées une tumeur, la galle du collet. Une autre espèce, Rhizobium (ex. Agrobacterium rhizogenes), parasite également les plantes selon les mêmes mécanismes qu’A.tumefaciens. Elle provoque le développement anarchique et très important du système racinaire appelé chevelu racinaire.
Transfert naturel de l’ADN-T par Agrobacterium tumefaciens
On a démontré que le parasitisme d’Agrobacterium repose sur le transfert d’une partie de son plasmide dans les chromosomes de la plante. Cette partie qui est transmise au génome de la plante est appelée ADN-T pour ADN Transféré.
Il s’agit d’une partie constante de l’ADN du plasmide de la bactérie qui est délimité par des bordures, bordure gauche et bordure droite, constituées par des séquences de 25 nucléotides. La région comprise entre ces frontières est transférée à la plante. Elle contient les gènes qui confèrent à la plante des propriétés tumorales, c’est-à-dire qu’ils entraînent la prolifération continue et incontrôlée des cellules végétales par production d’hormones de croissance.
Des gènes entraînant la synthèse d’opines sont également présents sur l’ADN-T. Les opines sont des acides aminés spécifiques des bactéries qui ne sont pas habituellement présentes dans les tissus végétaux sains. Les cellules végétales transformées synthétisent les opines qui favorisent la multiplication des souches pathogènes en détournant une partie de l’activité photosynthétique de la plante au profit des bactéries.
Sur le plasmide, en dehors de l’ADN-T, on trouve une région de virulence. Cette dernière n’entraîne pas directement la formation de la maladie, mais est indispensable au transfert et à l’intégration de l’ADN-T.
Transfert naturel de la construction génétique par Agrobacterium tumefaciens
Ce transfert naturel ou biologique de gènes, à l’aide d’Agrobacterium, est utilisé pour transformer les végétaux.
- tumefaciens est la bactérie la plus employée. Le principe est de modifier son plasmide Ti afin qu’il n’y ait pas de formation de la galle du collet, mais que le transfert et l’intégration des gènes désirés dans le génome des plantes se fasse.
- Des plasmides Ti désarmés sont construits. Pour ce faire, les gènes situés sur l’ADN-T, et responsables du pouvoir pathogène de la bactérie, sont délétés. Il est toutefois nécessaire, pour la réalisation du transfert de gènes, de garder intactes les deux bordures gauche et droite de l’ADN-T, ainsi que les fonctions de virulence. Entre les deux bordures de l’ADN-T est insérée la construction génique. Elle est ensuite introduite dans le végétal.
Les systèmes binaires de transfert
Des constructions ont été réalisées pour diminuer la taille des plasmides et pour simplifier les méthodes d’insertion de gènes dans l’ADN-T. Ainsi, l’information génétique, nécessaire au transfert et à l’intégration dans le matériel végétal de la construction génique, a été répartie en deux plasmides.
L’un est le plasmide d’Agrobacterium sans son ADN-T et possédant encore les gènes de virulence. Il induit à distance le transfert de l’ADN-T recombiné de l’autre plasmide, on parle d’action en trans. L’autre plasmide est un vecteur de petite taille qui porte l’ADN-T recombiné, donc la construction génique. Ce vecteur, appelé vecteur binaire, possède la capacité de se répliquer dans Agrobacterium mais aussi dans E. coli. C’est donc à la fois un vecteur de transfert et un vecteur de clonage.
Pour en savoir plus
Bacillus thuringiensis (ou bacille de Thuringe) est une bactérie très présente dans les sols, l’eau, l’air ou sur le feuillage des plantes.
Bacillus thuringiensis a été découvert et isolé par un bactériologiste japonais qui étudiait ses propriétés létales sur le ver à soie. Cette bactérie est utilisée pour protéger des plantes depuis 1933. À partir de 1950, son utilisation a été étendue aux forêts et aux vignobles. Dans les forêts, Bacillus thuringiensis permet de lutter contre les lépidoptères défoliateurs.
Depuis 1976, des formes de cette bactérie permettent de lutter contre les larves de moustiques, de coléoptères et de simulies, moucherons piqueurs qui se nourrissent de sang et propagent des maladies.
Bacillus thuringiensis (ou Bt) est donc l’insecticide le plus utilisé au monde en agriculture biologique. Il représente 95% des biopesticides.
LE TRANSFERT DIRECT
Des méthodes dites de transfert direct utilisent des moyens physiques ou chimiques pour permettre la pénétration d’ADN, généralement sous forme de plasmides dans une cellule végétale.
Cette technique fait intervenir :
- soit une projection d’ADN (biolistique) dans les cellules de la plante par l’utilisation d’un canon à particules qui projette dans les cellules des microparticules de métal (or ou tungstène) enrobées des constructions géniques,
- soit l’introduction d’ADN dans des protoplastes, par action d’un agent chimique ou d’un champ électrique (électroporation).
La biolistique
Le principe consiste à projeter sur des tissus des microparticules de tungstène ou d’or de 1 à 3 µm (1 µm = 10-6 m) de diamètre enrobées d’ADN, à l’aide d’un canon à particules. La force de propulsion est obtenue par détente d’un gaz sous pression (l’hélium le plus souvent). Certaines des micro-particules pénètrent dans les cellules, transportant avec elles l’ADN. Quand la bille atteint le noyau, elle permet à l’ADN qu’elle transporte de s’y intégrer.
Cette méthode est facile d’emploi et permet d’obtenir des plantes transgéniques, notamment chez les monocotylédones, comme le maïs, le blé, le riz. C’est ainsi qu’a été obtenu le premier maïs résistant à la pyrale.
Cette méthode peut parfois engendrer l’insertion de nombreuses copies du gène d’intérêt. Il faut donc trier les plantules obtenues par analyse moléculaire.
L’utilisation de protoplastes
Les protoplastes constituent un matériel privilégié pour le transfert direct de gènes. Débarrassées de leur paroi pectocellulosique, ils ne présentent plus d’obstacle à l’intégration de l’ADN. Pour provoquer une perméabilisation temporaire et réversible de la membrane plasmique des protoplastes en culture avec l’ADN, on procède à des modifications des conditions physico-chimiques du milieu. Les molécules d’ADN pénètrent ainsi dans les protoplastes et certaines d’entre elles s’intègrent à l’ADN du noyau. Dans ce cas, le protoplaste est transformé.
Deux techniques principales permettent d’introduire l’ADN dans les protoplastes :
- L’action du PolyÉthylène Glycol (PEG). Le PEG est un polymère qui déstabilise de façon réversible les membranes plasmiques, permettant ainsi le transfert de l’ADN au travers de la membrane. Cette méthode a permis l’obtention de maïs résistant à un herbicide, le glufosinate. Elle est également utilisée pour la betterave.
- L’électroporation. Cette méthode consiste à soumettre un mélange ADN-protoplastes à un choc électrique pendant une fraction de seconde. La membrane plasmique se trouve ainsi perméabilisée, ce qui permet l’intégration de l’ADN dans les cellules.
Ces deux méthodes sont relativement faciles à mettre en œuvre, mais supposent toutefois la possibilité de régénérer des plantes à partir de protoplastes, ce qui limite leur emploi chez les espèces récalcitrantes. Les techniques de transfert direct nécessitent également une étape de sélection des cellules transformées.

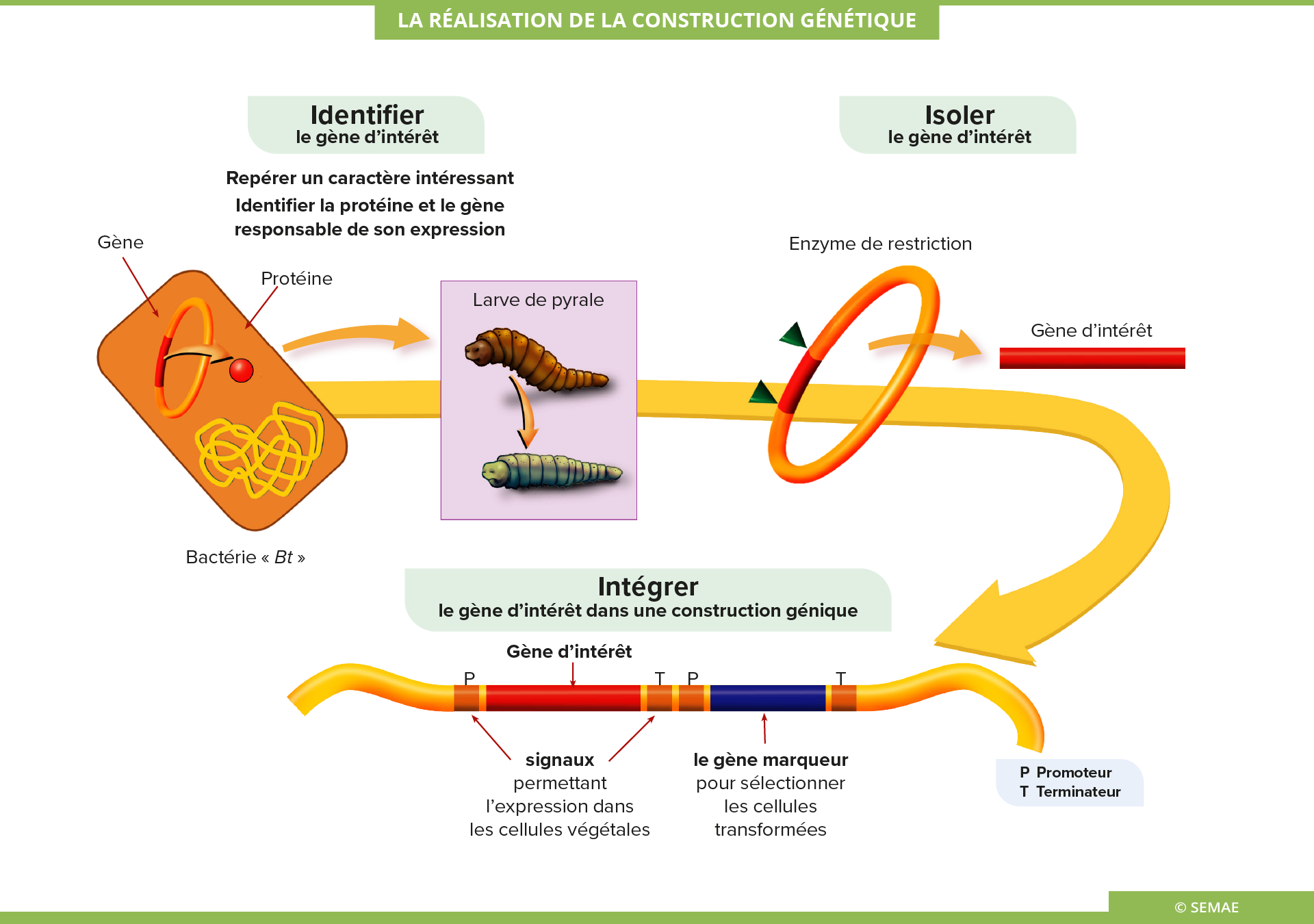
LA RÉALISATION DE LA CONSTRUCTION GÉNIQUE
Identifier et isoler le gène d’intérêt
La construction d’un transgène débute par le repérage d’un caractère intéressant et l’identification de la protéine responsable de ce caractère, puis du gène codant cette protéine.
Par exemple, une bactérie, Bacillus thuringiensis, utilisée en pulvérisation pour lutter contre certains papillons ravageurs des cultures de maïs, possède un gène permettant la production d’une protéine qui se transforme en toxine dans le tube digestif de la pyrale.
Ce gène d’intérêt a ensuite été isolé et cloné.
Intégrer le gène d’intérêt dans une construction génique
Un gène d’intérêt est constitué d’un promoteur, d’une séquence codante et d’un terminateur.
- Les signaux. Des signaux de régulation sont indispensables. Le promoteur, séquence située en amont du gène, est responsable de la transcription de l’ADN. Une séquence terminatrice est également indispensable. Située en aval, elle signale la fin de la séquence codante. D’autres séquences peuvent être ajoutées. Elles permettent de réguler l’intensité de l’expression du gène ou de cibler le lieu d’accumulation de son produit (protéine).
- Les gènes de sélection. Ces gènes permettent de repérer et de sélectionner, au cours des étapes suivantes de la transformation génétique, les cellules ayant intégré le gène d’intérêt. Il peut s’agir de gènes de résistance à des antibiotiques ou à des herbicides. Les cellules transgéniques sont alors sélectionnées par l’expression de leur résistance dans un milieu contenant l’antibiotique ou l’herbicide.
Tous ces fragments de gènes d’origines différentes, promoteur, séquence codante, terminateur et gènes de sélection, sont assemblés in vitro. On obtient ainsi la construction génique qui est multipliée puis utilisée pour l’étape de transformation.
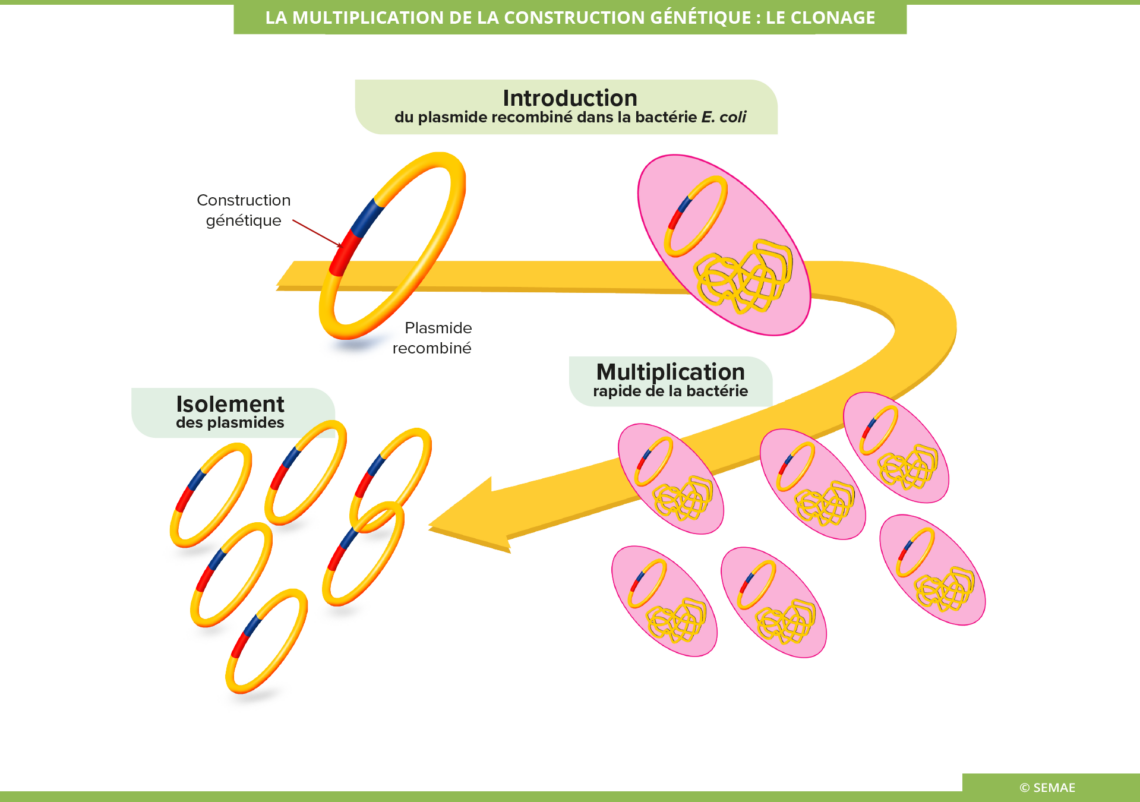
LA MULTIPLICATION DE LA CONSTRUCTION GÉNIQUE : LE CLONAGE
Les plasmides sont des molécules d’ADN circulaires présentes chez les bactéries, en plus de leur unique chromosome. Ils sont utilisés pour héberger la construction génique, car il est relativement facile de travailler sur cette petite molécule d’ADN circulaire, qui possède de nombreux sites de restriction. C’est alors un plasmide recombiné.
Le plasmide recombiné est ensuite réintégré dans une bactérie hôte, Escherichia coli. Par culture de cette bactérie, on obtient une multiplication rapide du plasmide. C’est l’étape de clonage de la construction génique. Par cette méthode de nombreuses copies du plasmide recombinant sont ainsi obtenues.