- Fixer plus rapidement les caractères
- La culture d’embryons immatures
- Faciliter l’introduction de nouveaux caractères
- Le sauvetage d’embryons interspécifiques
- L'hybridation somatique
- La mutagénèse
- La transgénèse : domaines d'application
- La transgénèse : stratégies
- La transgénèse : les étapes
- L'obtention d’une variété OGM
- Les méthodes récentes
- CRISPR-CAS9
- La biologie de synthèse
Les méthodes récentes d’amélioration des plantes
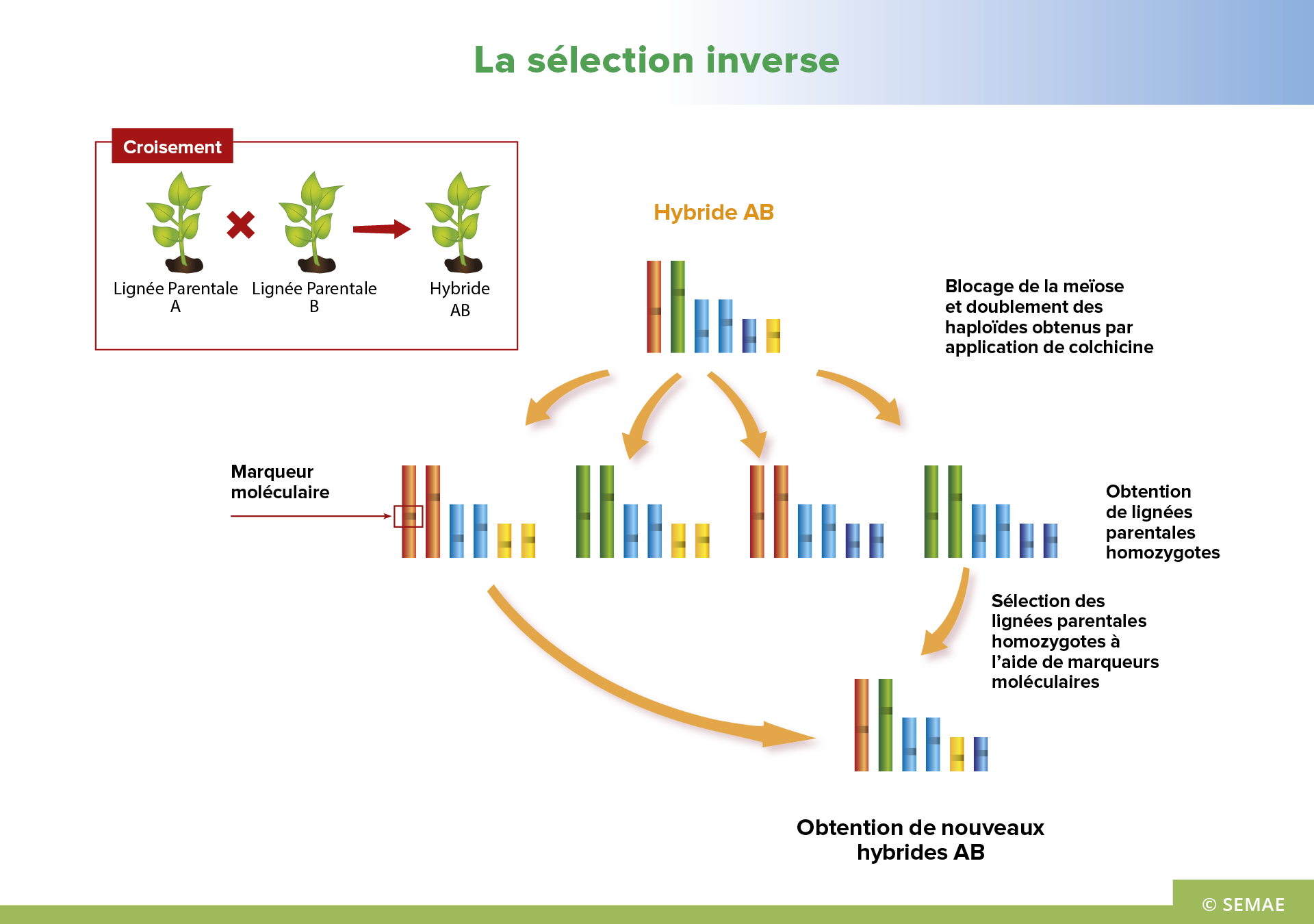
LA SÉLECTION INVERSE
La sélection classique permet de produire des hybrides (hétérozygotes) à partir du croisement de lignées parentales homozygotes. Ces lignées parentales font au préalable l’objet d’un long travail de sélection. Ensuite elles sont croisées afin d’obtenir des hybrides.
La sélection inverse permet, à partir d’hybrides de « créer » rapidement les lignées parentales homozygotes qui pourront, par leur croisement, reproduire ces hybrides.
La création des lignées parentales se fait en bloquant les mécanismes de recombinaison qui ont lieu à la méiose, souvent en utilisant une plante intermédiaire, transgénique et capable d’inhiber la recombinaison. La séquence transgénique n’est pas conservée dans les lignées obtenues et dans l’hybride ; elle est éliminée par ségrégation génétique. Le blocage de la méiose se fait par modification génétique ou, plus rarement, par l’utilisation de mutants pour les gènes impliqués dans la méiose.
Le génome des plantes obtenues est ensuite doublé à l’aide de colchicine pour obtenir des lignées homozygotes. Parmi ces lignées, il faut pouvoir repérer et sélectionner les lignées parentales intéressantes, étape qui peut se faire avec l’aide de marqueurs moléculaires.
La vigueur hybride est essentielle pour obtenir de meilleur rendement pour de nombreuses plantes. Il est donc très intéressant par cette nouvelle technique de sélection inverse de pouvoir, à partir d’un hybride intéressant mais dont on ne connait pas les parents, recréer les lignées parentales homozygotes de cet hybride.
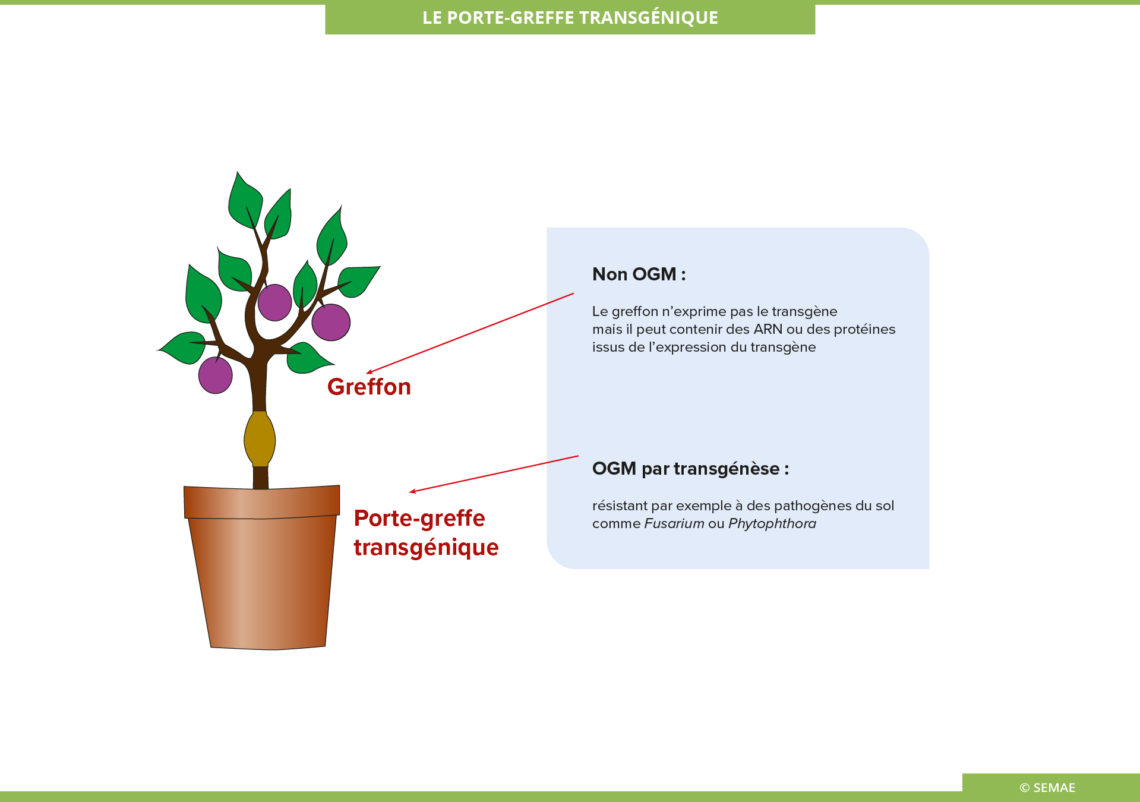
LE PORTE-GREFFE OGM
La greffe des plantes est une technique très ancienne, surtout en viticulture, pour les arbres fruitiers et pour certaines potagères. L’utilisation d’un porte-greffe OGM s’avère une piste intéressante pour lutter contre certaines maladies du sol.
Un essai de porte-greffe OGM a été développé et testé par l’INRAE sur la vigne pour lutter contre le virus du court noué véhiculé par des nématodes du sol.
Le porte-greffe peut être modifié par cisgénèse ou intragénèse.
Il peut être aussi envisagé un greffon OGM sur un porte-greffe non OGM.
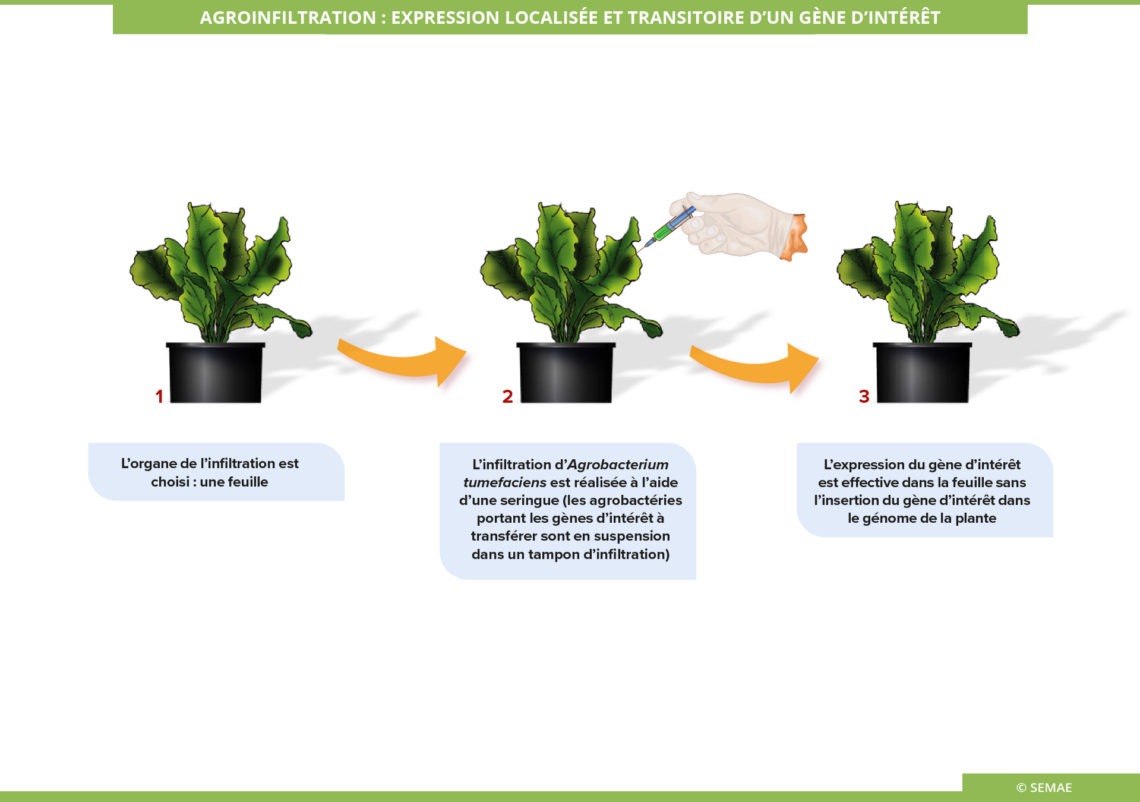
L’AGROINFILTRATION : EXPRESSION LOCALISÉE ET TEMPORAIRE D’UN GÈNE D’INTÉRÊT
Les bactéries génétiquement modifiées produisent plus facilement et surtout plus rapidement, des protéines à usage pharmaceutique ou industriel que les plantes transformées. Or les bactéries sont incapables d’ajouter des sucres (glycosylation) lesquels sont indispensables au fonctionnement de nombreuses protéines. Ainsi la plupart des protéines médicaments sont synthétisées dans des cellules animales en culture ce qui revient excessivement cher.
Produire ces protéines complexes dans les plantes est déjà une réalité mais reste un challenge international. Cette technique est en effet beaucoup moins onéreuse en raison de la grande quantité de protéines d’intérêt produites. Néanmoins, il peut être intéressant d’utiliser une plante non transformée comme support d’expression d’une bactérie transformée.
En mettant en contact des plantes ou des parties de plantes avec des Agrobacterium modifiées, il est possible d’intégrer transitoirement le gène d’intérêt préalablement introduit dans la bactérie. La plante exprime alors la protéine désirée. Ce sont les cellules somatiques qui assurent cette expression et non les cellules germinales. En effet, les plantes sont utilisées avant la reproduction et il n’y a donc pas d’insertion et de transmission de transgène possible.
L’intérêt de la production par les plantes de protéines à usage industriel ou thérapeutique est triple : production de protéines à grande échelle, coût extrêmement réduit et absence de contamination par des pathogène animaux ou humains (prions et virus, par exemple). Cette technique est également utilisée en recherche pour déterminer la fonction des gènes via le phénotype associé.
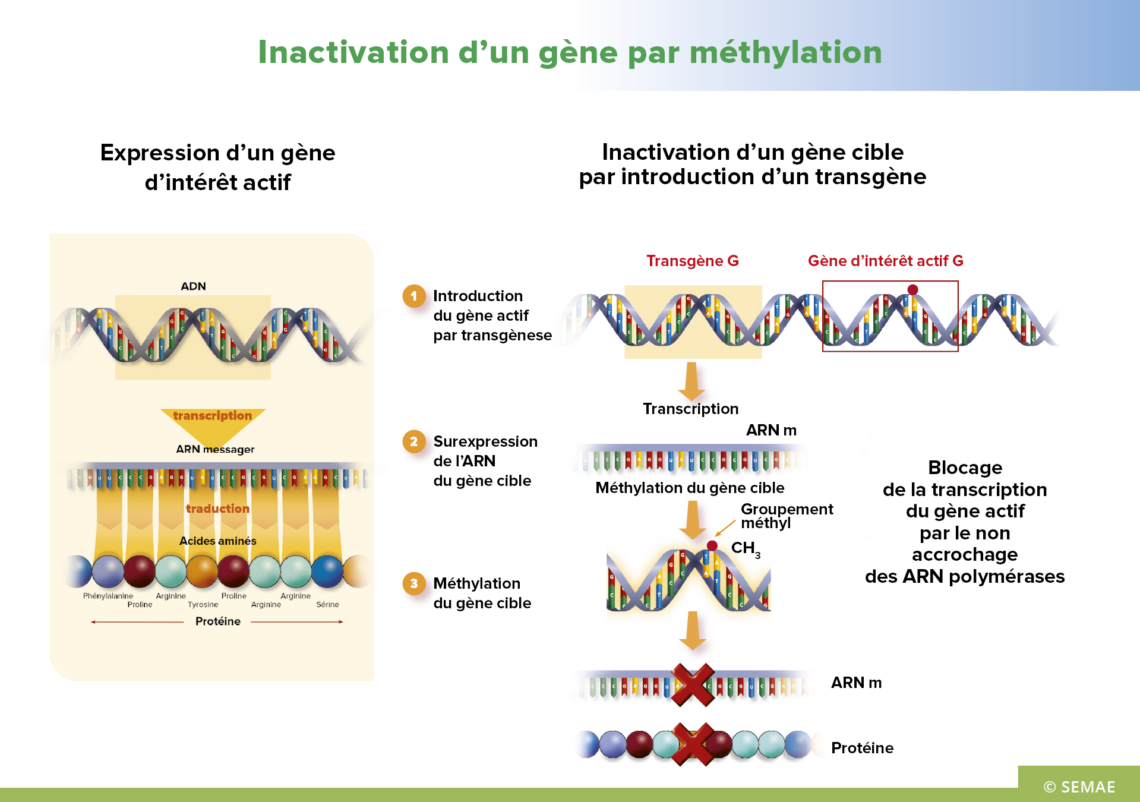
INACTIVATION DES GÈNES PAR MÉTHYLATION
Certaines régions de l’ADN peuvent parfois être pourvues d’un groupement méthyle (CH3) lié à un nucléotide. Il bloque les mécanismes de la transcription et donc, in fine, la synthèse protéique.
La méthylation d’une séquence d’ADN ne modifie pas la séquence, mais modifie son expression, en conduisant, dans la plupart des cas, à la disparition d’un caractère. Il s’agit d’un effet épigénétique, c’est-à-dire de modifications de l’expression du génome d’un organisme mais sans modification de la séquence de l’ADN.
Ce phénomène est observé dans la nature ; il est parfois le résultat d’une surexpression d’un gène et donc de la surproduction de l’ARN correspondant.
D’où l’idée d’introduire dans la plante un transgène permettant la synthèse d’ARNm (sous forme de double brin) spécifique du gène que l’on souhaite éteindre. Ce transgène surexprimé déclenche alors la méthylation du gène ciblé et supprime son expression.
Cette modification induite est permanente chez les plantes qui contiennent le transgène à l’origine de la méthylation. Elle peut être transmise aux descendants qui par ségrégation ne possèdent plus le transgène, mais dans ce cas, cette propriété s’estompe au bout de quelques générations.