- Fixer plus rapidement les caractères
- La culture d’embryons immatures
- Faciliter l’introduction de nouveaux caractères
- Le sauvetage d’embryons interspécifiques
- L'hybridation somatique
- La mutagénèse
- La transgénèse : domaines d'application
- La transgénèse : stratégies
- La transgénèse : les étapes
- L'obtention d’une variété OGM
- Les méthodes récentes
- CRISPR-CAS9
- La biologie de synthèse
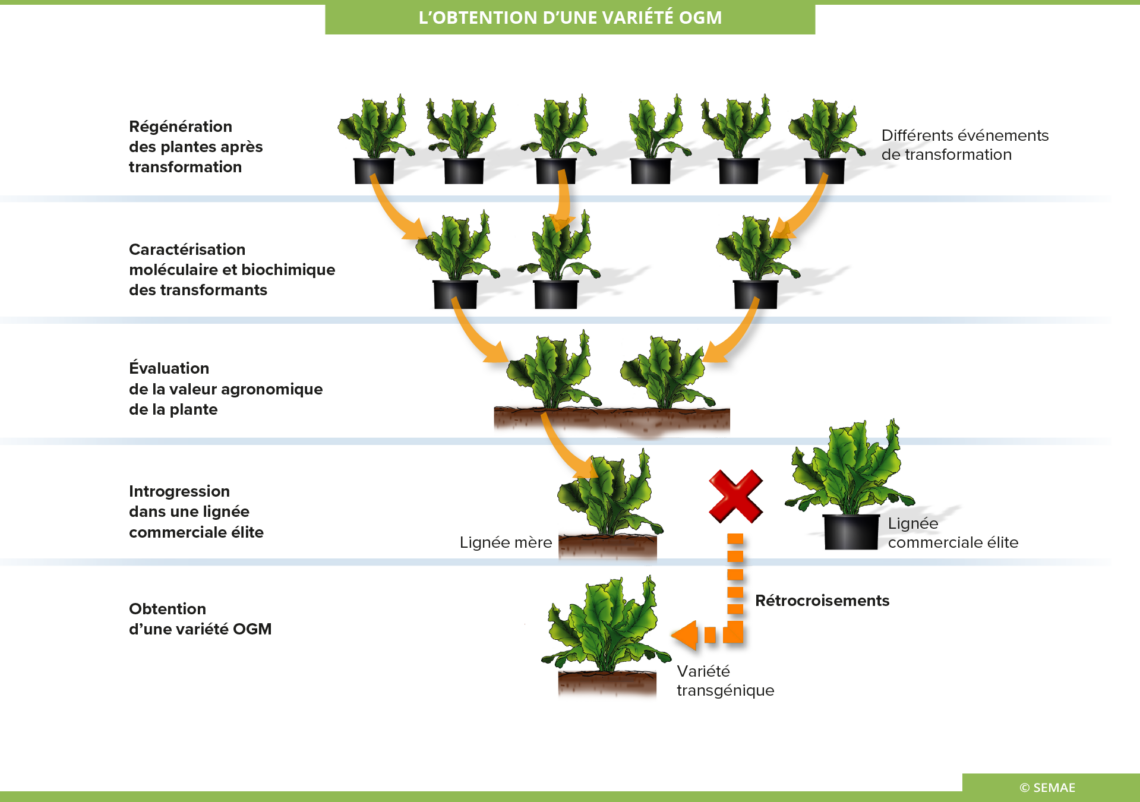
L’obtention d’une variété OGM
Il faut d’abord s’assurer qu’une plante sélectionnée par sa résistance à un agent de sélection, herbicide ou antibiotique, a bien intégré le gène d’intérêt dans son génome. Ensuite, l’événement de transformation doit être caractérisé. Ainsi des analyses moléculaires sont conduites afin d’analyser les événements de transformation.
Enfin, il faut s’assurer que le gène introduit s’exprime et produit la protéine désirée, en quantité suffisante. Pour cela, des analyses biochimiques sont réalisées. A cette étape, de nombreuses plantes transgéniques seront éliminées par défaut d’expression du gène d’intérêt. Il faut également s’assurer que la protéine d’intérêt est active (activité enzymatique en général).
Évaluation de la valeur agronomique de la plante
Des analyses portent également sur le comportement général de la plante. Il s’agit de savoir si le gène introduit confère le caractère souhaité, et de valider l’efficacité du caractère. D’autre part, la localisation d’insertion du gène étranger peut interférer avec le métabolisme général de la plante. Il faut donc vérifier que le potentiel de la plante n’est pas atteint. Ainsi, des tests en serre et en champ sont menés.
Il est notamment très important de vérifier que le comportement au champ de plantes transgéniques correspond à celui attendu sur la base des observations effectuées en serre sur une ou quelques plantes. A ce stade, le niveau et la stabilité de l’expression du caractère dans différentes conditions de culture sont évalués. Seules quelques plantes seront retenues.
Enfin, il faut caractériser la transmission du caractère à la descendance.
Introgression dans une lignée commerciale élite
La plante ayant intégré le gène d’intérêt et satisfaisant le mieux à l’évaluation agronomique est retenue, on parle de lignée mère. Toutefois, cette plante n’est généralement pas encore la variété commerciale. En effet, l’efficacité de transformation et de régénération étant dépendante du génotype, la plante qui a été transformée est d’un génotype facilitant ces étapes.
Le gène est ensuite transféré dans une lignée commerciale élite par rétrocroisements. Au cours de ces générations d’hybridation, seul le gène d’intérêt est conservé et le reste du patrimoine génétique de la lignée mère est éliminé. Le résultat de ce processus est l’obtention d’une lignée quasiment identique à la lignée élite, mais contenant le nouveau caractère transgénique. La variété transgénique obtenue est alors proposée à l’inscription.
L’obtention d’une variété OGM est le résultat de nombreuses années d’analyses et d’expérimentations.
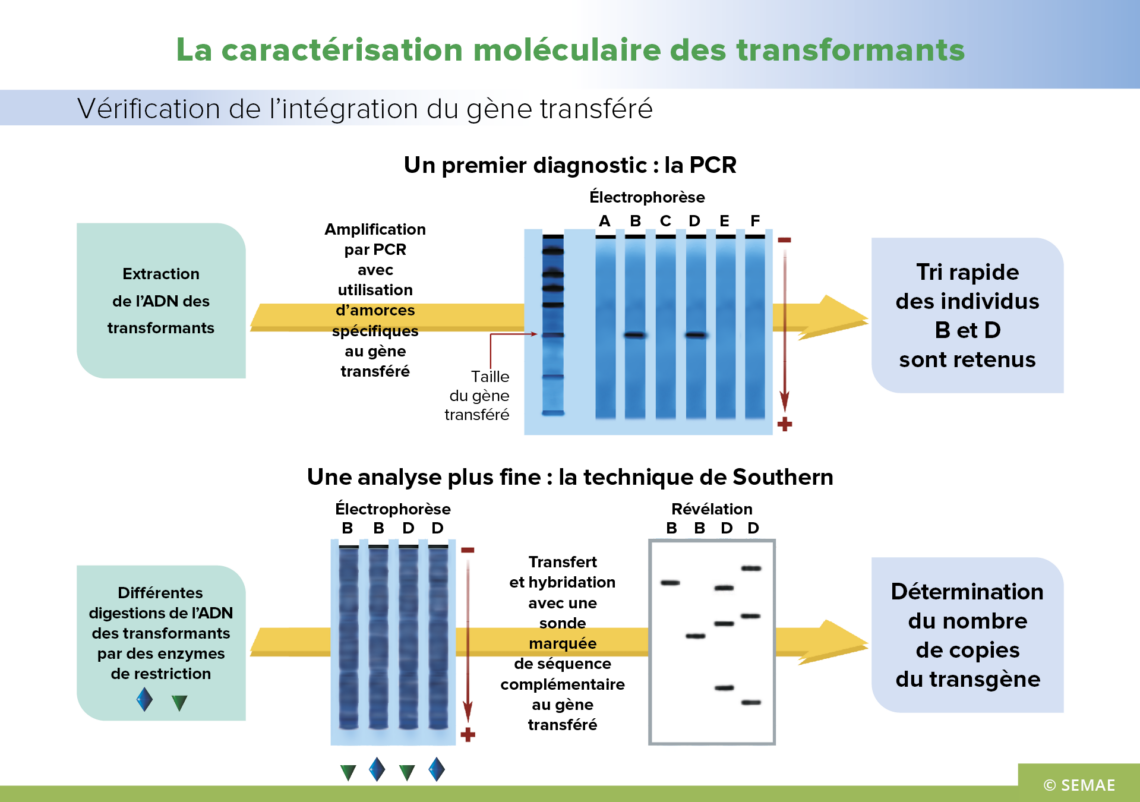
LA CARACTÉRISATION MOLÉCULAIRE DES TRANSFORMANTS
Lorsque l’on transforme génétiquement une plante, il est important de déterminer rapidement si l’ADN transféré est intégré dans le patrimoine génétique de la plante. En effet, la sélection des cellules sur un milieu contenant l’agent de sélection n’est pas suffisamment fiable. Certaines cellules, bien que non transformées, parviennent quand même à se développer sur le milieu de sélection.
Un premier diagnostic : la PCR (Polymerase Chain Reaction)
La PCR, réaction de polymérisation en chaîne, permet sur d’infimes quantités d’ADN de détecter l’éventuelle présence du transgène. A l’aide d’amorces spécifiques, cette technique permet de déterminer si une plante porte le transgène ou non, et permet également de suivre la transmission du nouveau gène dans la descendance. Les fragments amplifiés sont visualisés par migration sur un gel et leur taille est comparée à celle du fragment attendu. Ainsi sur l’électrophorèse, seules les plantes B et D possèdent un fragment pouvant correspondre au gène d’intérêt transféré. Pour caractériser si ce gène s’exprime, la PCR reverse (RT-PCR) peut être utilisée ce qui permet de vérifier la présence d’ARN messager, transcrit spécifiquement à partir du gène introduit.
Une analyse plus fine : la technique de Southern
Une analyse plus fine pourra ensuite être réalisée par hybridation moléculaire ADN-ADN, selon la technique de Southern. Seule l’hybridation spécifique permet de démontrer que le gène transféré est intégré dans le génome. L’ADN total de la plante est digéré séparément par différentes enzymes de restriction. Les fragments d’ADN ainsi obtenus sont séparés par électrophorèse. Ils sont ensuite transférés par capillarité sur une membrane en nylon. Enfin, une hybridation à l’aide d’une sonde marquée (correspondant à tout ou une partie du gène transféré) permet de déterminer le nombre de copies du transgène intégrées au génome de la plante. Ainsi dans le cas des plantes B et D, B possède une seule copie et D trois copies.
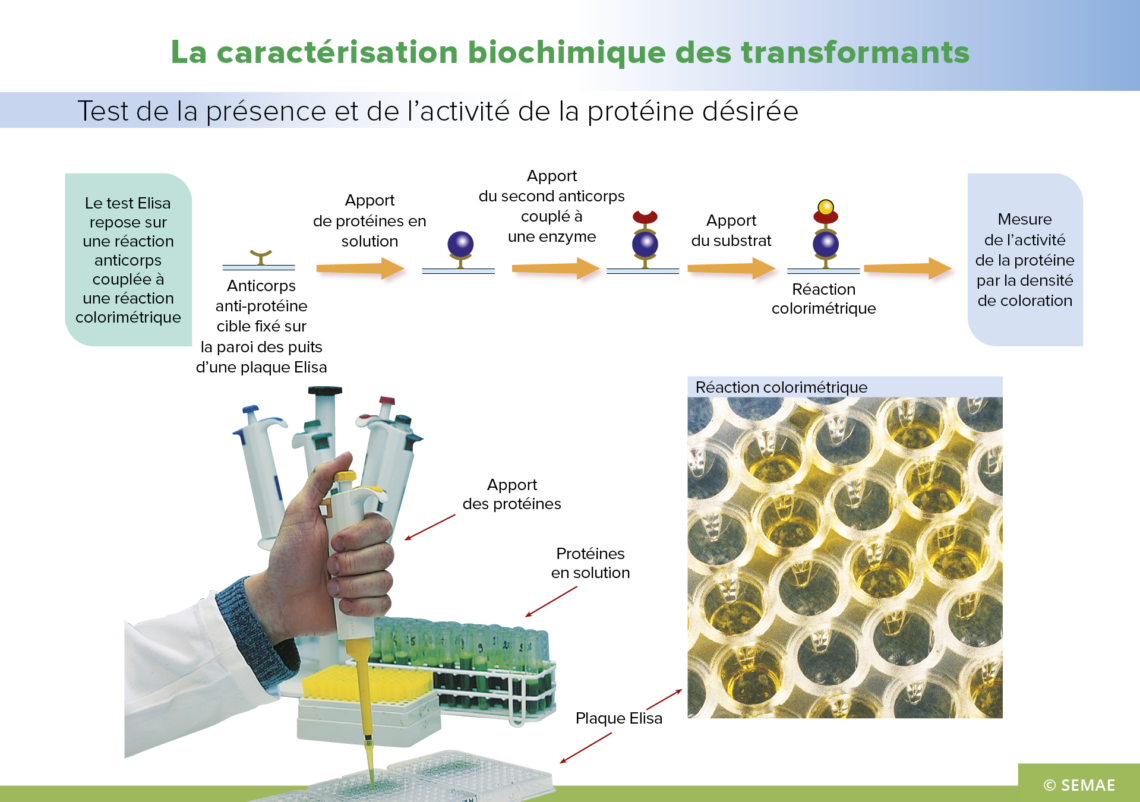
LA CARACTÉRISATION BIOCHIMIQUE DES TRANSFORMANTS
Après vérification de la présence du nouveau gène dans la plante, il est nécessaire de déterminer si ce gène produit ou non la protéine désirée et en quelle quantité. Pour tester la présence et l’activité de la protéine, un test Elisa (Enzyme Linked Immuno Sorbent Assay, Immuno-essais avec couplage enzymatique) est utilisé.
Pour cela, les protéines sont obtenues à partir du broyage de tissus de plantes transformées. Ce test repose sur une liaison spécifique entre un anticorps anti-protéine cible fixé à la paroi des puits d’une plaque Elisa et la protéine produite par le gène. Un deuxième anticorps spécifique de la protéine, couplé à une enzyme, est ajouté dans le milieu. Si la protéine est présente, il se forme un complexe anticorps-protéine-anticorps. Ensuite, on réalise un test colorimétrique : le substrat de l’enzyme est ajouté au milieu, il se lie sur les complexes fixés à la paroi et la solution change de couleur. C’est donc une méthode visuelle de détection de la présence de la protéine.
Un lecteur de plaque Elisa permet de mesurer l’activité de la protéine, sur la base de différences d’intensité de couleur. Sur la photographie représentant la plaque Elisa, certains puits ont changé de couleur. Dans les puits restés clairs, les plantes n’ont pas produit de protéine, elles seront donc éliminées, tandis que dans les puits dont la couleur a changé, il y a eu production de la protéine désirée. C’est une méthode simple de révélation.
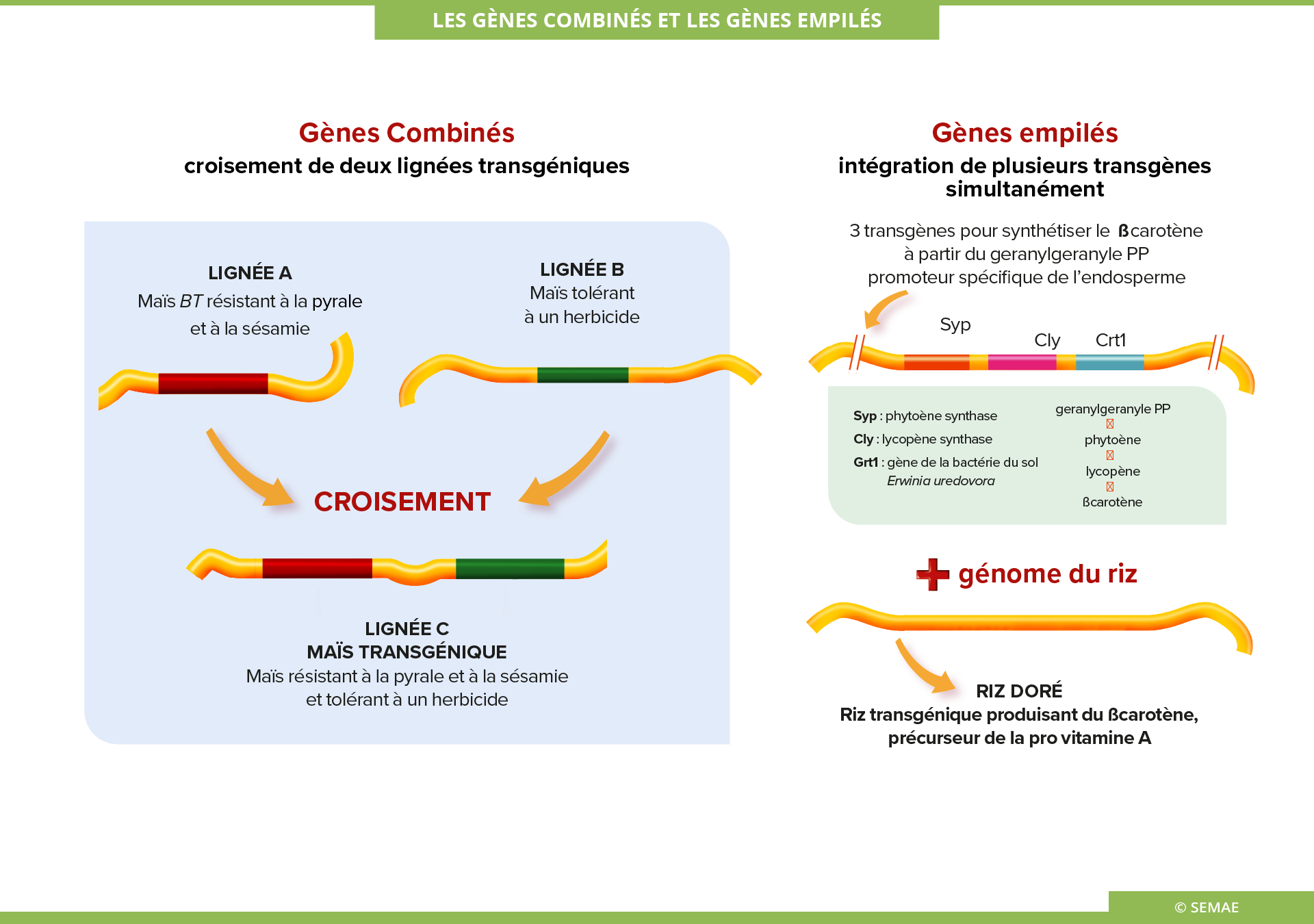
LES GÈNES COMBINÉS ET LES GÈNES EMPILÉS
La majorité des plantes cultivées ont été sélectionnées pour leurs multiples avantages agronomiques, leur rendement ou la qualité de leurs produits. Ces avantages agronomiques peuvent être également cumulés dans une plante transgénique, avec la combinaison ou l’empilement de plusieurs transgènes.
Comment les gènes sont-ils combinés ou empilés ?
Les gènes peuvent être combinés par croisement classique de lignées OGM. C’est le cas de la plupart des variétés existantes. Mais ces techniques de croisement de variétés OGM répondent aux lois de ségrégation classique (la séparation des allèles). Il peut donc s’avérer compliquer d’obtenir l’insertion de trois ou quatre gènes différents dans une lignée homozygote.
Au contraire, la technique des gènes empilés permet de contourner ce problème. Cette technique consiste à introduire simultanément plusieurs gènes différents dans une même variété. Elle permet d’obtenir des caractères « complexes » par modification ou création de voies métaboliques. Par exemple, dans le cas de l’obtention du riz doré, plusieurs séquences d’ADN ont été insérées simultanément pour permettre la synthèse de provitamine A.
Le riz doré a été créé par transformation du riz avec trois gènes de biosynthèse de la bêta-carotène :
- Syp (phytoene synthase),
- cly (lycopène cyclase), les deux venant de la jonquille (Narcissus pseudonarcissus),
- crt1 de la bactérie de sol Erwinia uredovora
Les gènes syp, cly et crt1 ont été transformés dans le noyau du génome et placés sous le contrôle d’un promoteur spécifique de l’endosperme, de sorte qu’ils soient seulement exprimés dans l’endosperme. L’utilisation du gène de la bactérie crt1 permet de catalyser de nombreuses étapes de la synthèse du caroténoïde avec l’aide des séquences syp et cly, alors que toutes ces étapes nécessitent beaucoup plus d’enzymes au niveau de la plante.
Les variétés transgéniques dites globalement « à empilement » (ou stacked genes) sont de plus en plus nombreuses (près de 50% des surfaces OGM en 2014) et comportent de plus en plus de transgènes. Par exemple, une variété OGM de maïs a été obtenue par le croisement de plusieurs variétés OGM combinant la tolérance à deux herbicides et la résistance à la pyrale et la sésamie via l’ajout de six transgènes Bt différents.
Quels sont les caractères concernés ?
Les caractères communément empilés concernent la résistance aux insectes et la tolérance aux herbicides. L’empilement de gènes différents dans une même plante transgénique permet d’obtenir par exemple une résistance à la fois à la pyrale, à la sésamie et à la chrysomèle.
Les caractères récemment empilés concernent la tolérance à la sécheresse (maïs), la valeur nutritionnelle (soja), la résistance aux champignons et aux nématodes, l’augmentation des rendements ou lors de la production de biocarburants, l’augmentation des rendements de conversion biologique (fermentation ou distillation).