- Fixer plus rapidement les caractères
- La culture d’embryons immatures
- Faciliter l’introduction de nouveaux caractères
- Le sauvetage d’embryons interspécifiques
- L'hybridation somatique
- La mutagénèse
- La transgénèse : domaines d'application
- La transgénèse : stratégies
- La transgénèse : les étapes
- L'obtention d’une variété OGM
- Les méthodes récentes
- CRISPR-CAS9
- La biologie de synthèse
Fixer plus rapidement les nouveaux caractères
L'HAPLODIPLOÏDISATION
L’haploïdie se produit spontanément mais peu fréquemment chez le colza, le piment et les tomates. Selon les espèces, on obtient des plantes haploïdes par :
- La culture d’anthères (1964) : tabac
- La culture de microspores isolées (1973) : riz, colza, orge, blé, pomme de terre, maïs
- La culture d’ovaires ou d’ovules (1976) : orge, blé, tabac, riz, maïs, tournesol, betterave
- La culture de pollen (1983) : orge, blé, melon, carotte, concombre, chou
- A partir de croisements interspécifiques (1964) : pomme de terre, orge, melon, blé, luzerne
Obtention de lignées fixées en une seule génération
L’haplodiploïdisation est une méthode utilisée pour fixer plus rapidement le matériel génétique en cours de sélection. Elle repose sur l’obtention de plantes haploïdes (n) à partir des organes mâles ou femelles puis sur le doublement du stock chromosomique.
Ainsi le sélectionneur va disposer de plantes diploïdes (2n) homozygotes où l’ensemble du génome est fixé. C’est donc une technique rapide de production de lignées pures en une seule étape au lieu de 7 à 8 générations. Avec cette méthode, la durée d’un cycle de sélection est raccourcie de 3 à 4 ans.
Cette technique présente en plus l’avantage de faciliter la sélection. En effet, le sélectionneur pourra faire un choix plus large, car l’haplodiploïdisation fixe les différentes recombinaisons possibles entre les caractéristiques des lignées parentales. Il pourra également faire un choix plus sûr car il possède un matériel homogène. Il y a donc séparation des deux phases de la création variétale : la fixation des caractères d’une part et la sélection des meilleures plantes d’autre part. De plus, cette méthode permet d’observer l’expression aussi bien des gènes récessifs que des gènes dominants. Ceci est particulièrement intéressant en sélection.
Applications
Cette technique est largement utilisée chez l’asperge, le blé, le colza, l’orge, l’aubergine et le piment. La variété Florin, inscrite au catalogue en 1985 est le premier blé français issu d’haplodiploïdisation à partir de cultures d’anthères.

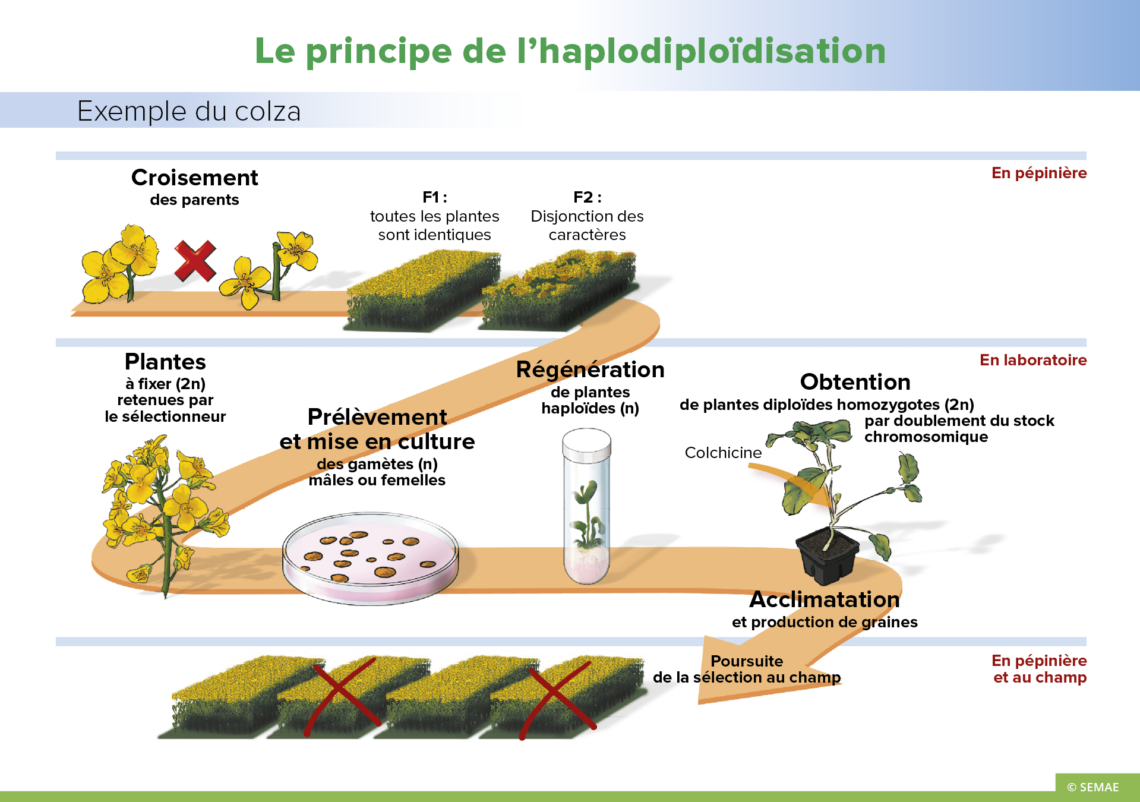
LE PRINCIPE DE L’HAPLODIPLOÏDISATION
Le processus d’haplodiploïdisation comprend l’obtention de plantes haploïdes à partir des cellules produisant les gamètes mâles ou femelles, et le retour vers la phase diploïde.
Production de plantes mères
Le sélectionneur effectue un croisement entre deux lignées parentales présentant des caractéristiques intéressantes et complémentaires. Ce croisement produira la génération F1. Ce sont les plantes mères pour l’obtention de la phase haploïde. A ce stade, toutes les plantes sont identiques. En revanche, sur ces plantes, la méiose à l’origine de la formation des gamètes permet les recombinaisons et la ségrégation des caractères, selon les lois de Mendel et les recombinaisons entre les chromosomes parentaux. Les individus F2 seront alors tous différents les uns des autres, c’est la disjonction des caractères. Pour faciliter le travail de sélection, l’haplodiploïdisation va permettre d’obtenir des plantes homozygotes.
Obtention de la phase haploïde
Il s’agit de récupérer les cellules ayant subi la méiose avant la fécondation. C’est là que commence le travail de laboratoire. L’obtention des plantes haploïdes peut se faire par culture in vitro de cellules destinées à fournir les cellules reproductrices ou gamètes. S’il s’agit de gamètes mâles, on parle d’androgenèse. S’il s’agit de gamètes femelles, c’est la gynogenèse. Une autre méthode d’obtention d’haploïdes est l’induction d’haploïdes in situ. On peut obtenir des haploïdes après croisements entre espèces ou entre genres. Il y a fécondation, mais les chromosomes incompatibles du parent pollinisateur sont rejetés naturellement. il est possible également de provoquer une fécondation anormale à l’aide de pollen dénaturé. Dans ces trois cas, on observe le développement d’un embryon haploïde. Une phase de sauvetage d’embryons in vitro est ensuite généralement nécessaire. Mis en culture sur des milieux particuliers, l’embryon haploïde se développe, les tissus se différencient pour donner des plantes haploïdes.
Retour à l’état fertile diploïde
Pour utiliser en sélection une plante régénérée par l’une de ces voies, il faut disposer de plantes fertiles et donc diploïdes. L’état haploïde étant instable, l’individu régénéré est parfois diploïde, par doublement spontané du stock chromosomique. Pour le blé, 20 à 25 % d’haploïdes sont doublés spontanément, 60 à 65 % chez l’orge. Sinon, il est possible de provoquer artificiellement un doublement des chromosomes, le plus couramment par l’action d’un agent chimique, la colchicine. Les plantes obtenues sont des diploïdes homozygotes : elles possèdent deux copies identiques de chacun de leurs chromosomes et portent donc des paires de gènes ou allèles identiques, d’où leur grand intérêt.
Sélection des lignées au champ
Le sélectionneur trie les plantes en fonction des critères agronomiques et technologiques recherchés. La multiplication de ces plantes se fait par autofécondation (naturelle ou induite): tous les descendants sont des copies identiques de leurs parents.
Traitement à la colchicine
La colchicine bloque la mitose en début de métaphase empêchant la séparation des chromosomes fils. La cellule conserve donc son génome doublé (n plus n =2n). Ainsi les cellules deviennent diploïdes. Le traitement à la colchicine peut se réaliser au stade plantule par trempage des racines ou injection dans les méristèmes. Les taux de doublement sont alors très variables (plante chimérique). Pour l’éviter, actuellement se développent des traitements in vitro au stade embryonnaire afin d’obtenir des individus dont toutes les cellules sont haploïdes doublés.
Déterminisme du niveau de ploïdie
Une vérification de la ploïdie des plantes régénérées peut être effectuée précocement par cytométrie de flux. Une substance fluorescente se liant à l’ADN permet la coloration des noyaux des cellules. La mesure de la densité de cette coloration permet de déterminer le niveau de ploïdie. Sinon, la constatation de la fertilité de la plante garantit qu’elle est effectivement diploïde.
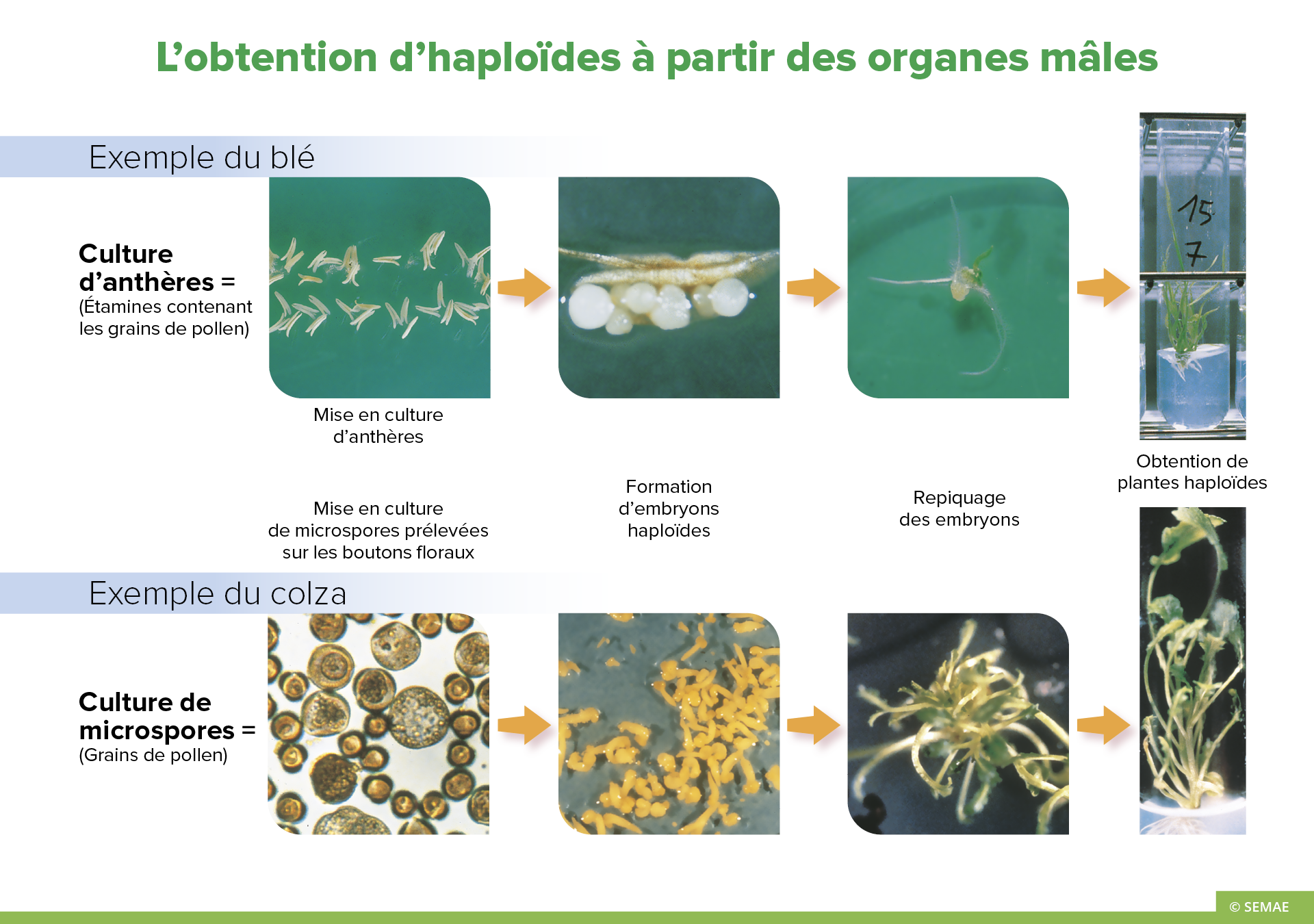
L’OBTENTION D’HAPLOÏDES À PARTIR DES ORGANES MÂLES
L’androgenèse a été la première voie d’obtention d’haploïdes in vitro. Les plantes haploïdes ont été obtenues par culture d’anthères (sacs contenant le pollen). Plus récemment, la culture de microspores (grains de pollen immatures) a été mise au point.
Culture d’anthères
L’androgenèse est la voie d’haplodiploïdisation privilégiée chez le blé, car il est relativement facile de mettre en culture un très grand nombre d’anthères. Ainsi, cette technique a été mise en place dans les programmes de sélection du blé tendre.
Les épis sont récoltés au stade montaison d’où les anthères sont extraites en conditions stériles. Elles sont mises en culture en boîte de pétri sur des milieux spécifiques, induisant le développement embryonnaire des microspores. Des examens cytologiques préalables sont nécessaires pour connaître le moment de prélèvement le plus favorable à ce développement. Les boîtes de pétri sont ensuite placées dans des chambres de culture où l’éclairement, la température et l’humidité sont contrôlés pour favoriser l’androgenèse. Quelques semaines après la mise en culture des anthères, les embryons haploïdes apparaissent. Ils sont prélevés sous loupe binoculaire et repiqués sur des milieux nutritifs permettant une différenciation des tissus et l’induction du développement de la plante. Les plantules bien développées sont à nouveau repiquées en tube.
Cette voie androgénétique est utilisée chez le blé, le riz, la pomme de terre, le tabac, le maïs, l’asperge et le piment et est très efficace sur colza, l’orge et l’aubergine.
Culture de microspores
Elle est utilisée en routine sur les crucifères comme le colza. Elle reste actuellement difficile sur les céréales (avoine, blé, riz…) et les légumineuses.
Chez le colza, les boutons floraux sont sélectionnés sur les inflorescences. Les grains de pollen immatures sont isolés mécaniquement par broyage des boutons, et filtration de la suspension. On induit directement la formation d’embryons par la culture des microspores en milieu liquide agité. A partir d’embryons de trois semaines, il est ensuite possible de régénérer des plantes.
La variété de colza d’hiver Goéland, inscrite en 1990, est issue de cette technique.
Application particulière à la production d’hybrides chez l’asperge
L’androgénèse a été particulièrement exploitée chez l’asperge, car elle est le seul moyen efficace pour produire des variétés hybrides mâles. L’asperge est une espèce dioïque : elle possède des pieds mâles et des pieds femelles. Les plantes mâles sont recherchées en sélection, car elles sont précoces et plus productives.
Les pieds mâles sont Mm pour les chromosomes sexuels et les femelles sont mm. La voie de l’androgenèse permet d’obtenir soit des individus MM appelés super-mâles, soit des individus mm donc femelles. Les croisements de ces super-mâles avec des femelles donnent des individus mâles, ce qui permet en les sélectionnant de pouvoir créer des variétés hybrides mâles. Ainsi, cela permet d’exploiter l’hétérosis, important chez cette espèce.
La variété Andréas a été la première variété inscrite en France (1995) intégrant cette technique.
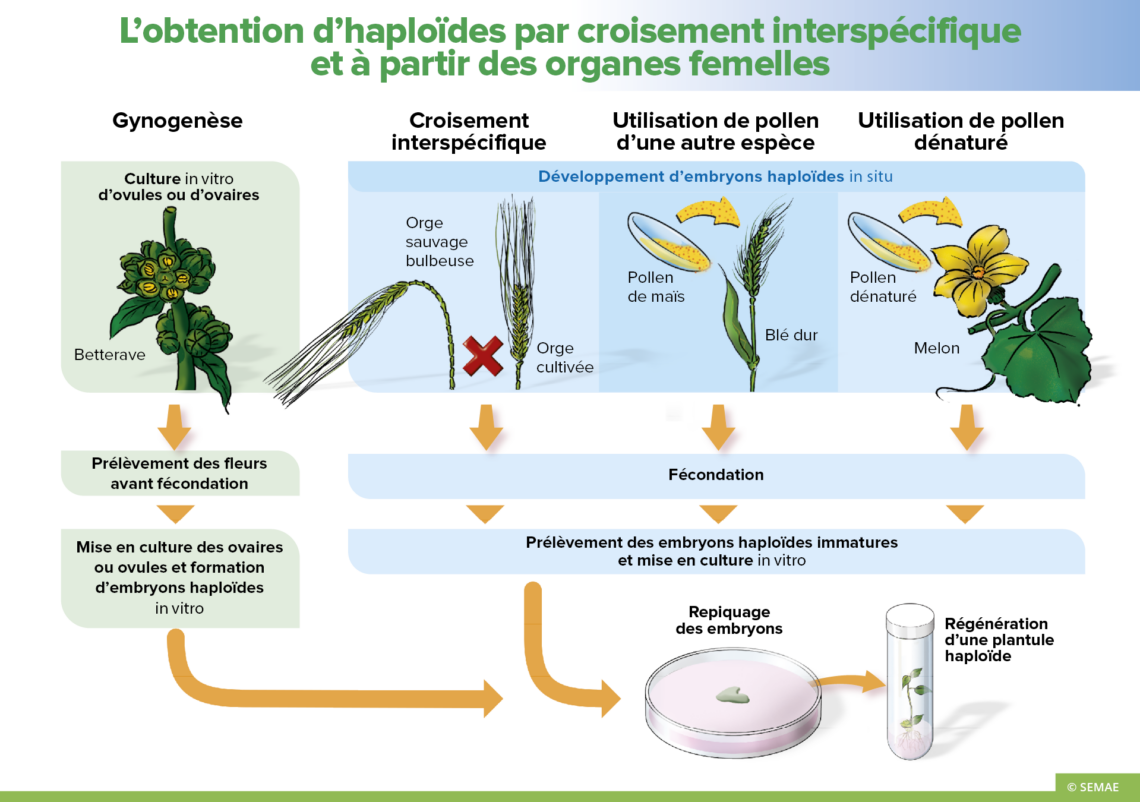
LES DIFFÉRENTES OBTENTIONS DE PLANTES HAPLOÏDES
Haploïdie induite par croisement interspécifique
Le croisement interspécifique entre une espèce cultivée et une espèce sauvage permet parfois de produire des plantes haploïdes. En effet, après fécondation au cours des premières divisions cellulaires, les chromosomes de l’espèce sauvage sont éliminés. On obtient ainsi un embryon haploïde ne comportant que les chromosomes de l’espèce cultivée. Cette méthode s’applique à l’orge, à la pomme de terre, ainsi qu’à quelques génotypes de blé. Le croisement interspécifique de l’orge cultivée et de l’orge sauvage bulbeuse permet l’obtention d’embryons haploïdes d’orge cultivée. La culture in vitro est alors nécessaire pour permettre à ce type d’embryon de poursuivre son développement et de donner une plante.
Une application particulière est utilisée pour la sélection de la pomme de terre. La pomme de terre cultivée est tétraploïde (4n = 48). La réduction du stock chromosomique est obtenue par pollinisation de la pomme de terre cultivée par une espèce sauvage Solanum phureja. Ce système permet d’obtenir des plantes diploïdes. Ces plantes peuvent être alors facilement croisées par des espèces sauvages, fréquemment diploïdes, ce qui permet de restaurer la tétraploïdie. Cette méthode est utilisée pour apporter de nouveaux caractères chez la pomme de terre cultivée.
Haploïdie induite par croisement inter-générique
Plus récemment, les croisements entre genres ont été étudiés. La pollinisation du blé dur par du pollen de maïs offre la possibilité de produire des plantes haploïdes chez le blé dur, espèce récalcitrante aux techniques de culture d’anthères.
Haploïdie induite par l’utilisation de pollen dénaturé
L’induction d’haploïdes est également possible par pollinisation avec du pollen dénaturé par irradiation. Cette technique s’est révélée utile pour tout un ensemble d’espèces légumières et est utilisée couramment chez le melon. L’étape de culture in vitro des embryons haploïdes est là aussi obligatoire.
Haploïdie induite par gynogenèse
Elle consiste à mettre en culture in vitro des ovules ou des ovaires prélevés sur la plante avant fécondation. Des plantes haploïdes ont pu être obtenues chez l’orge, le tabac, le blé, le riz, le maïs, la betterave…
Sur la betterave, la gynogenèse est la technique la plus opérationnelle de production d’haploïdes, même si on obtient moins de 8% d’haploïdes. Elle permet notamment de travailler sur des betteraves mâles fertiles, aussi bien que sur des betteraves mâles stériles (contrairement à la culture d’anthères). Les fleurs sont disséquées sous la loupe binoculaire en conditions aseptiques. Les ovules sont déposés sur une boîte de pétri contenant un milieu inducteur et sont placés en chambre de culture. Après trois semaines, des embryons commencent à germer et sont transférés sur un milieu permettant le développement des plantules.